Korozją nazywamy proces niszczenia metali oraz ich stopów na skutek chemicznego lub elektrochemicznego działania otaczającego ośrodka [2].

Korozję dzieli się na chemiczną i elektrochemiczną. Korozja chemiczna występuje przy działaniu na metal gazów oraz rozmaitych cieczy, na przykład wody. Metale niezabezpieczone w odpowiedni sposób, na przykład przez malowanie, bardzo łatwo korodują i ulegają pewnym przemianom, którym towarzyszy tworzenie się rdzy. Korozja elektrochemiczna związana jest z przepływem prądu od jednej części metalu do drugiej. Zachodzi ona przy działaniu na metale przewodników elektryczności, np. elektrolitów, do których zalicza się słoną wodę morską. Ten rodzaj korozji, stosunkowo szybko postępującej i groźnej w skutkach, występuje właśnie w elementach metalowych zanurzonych w wodzie morskiej. Temu rodzajowi korozji poświęcony jest niniejszy artykuł.
Do budowy kadłubów jachtów (poza drewnem i laminatem) i ich wyposażenia stosuje się różne metale. Jeśli takie metale będą zanurzone w wodzie morskiej, to może między nimi wystąpić przepływ prądu przez wodę, która pełni funkcję elektrolitu. Przepływ ten wywołany jest różnicą potencjałów, jaka wytwarza się między różnymi metalami, wśród których znajdują się metale bardziej lub mniej szlachetne. Miarą szlachetności metali jest ich tzw. normalny potencjał elektrodowy. Im bardziej szlachetny jest metal, tym wyższą posiada wartość potencjału. Metale uszeregowane według rosnących wartości potencjału tworzą szereg napięciowy (tab.1). Każdy metal o niższym potencjale wypiera z roztworu soli metal o wyższym potencjale. Ciągły przepływ prądu po pewnym czasie może spowodować ubytki korozyjne w elemencie wykonanym z mniej szlachetnego metalu. Zjawisko takie nazywane jest korozją elektrochemiczną.
| Bardziej szlachetne metale (elektroujemne) |
| Stop Monela Nikiel Stal nierdzewna z dużą zawartością chromu Brąz silikonowy (krzemowy) Miedź i farby metaliczne z zawiesiną miedzi Brąz cynowy Brąz aluminiowy Mosiądz Brąz fosforowy Brąz magnezowy Cyna Ołów Stal nierdzewna z małą zawartością chromu Żeliwo Stal Aluminium Kadm Stal cynkowana Cynk Magnez |
| Mniej szlachetne metale (elektrododatnie) |
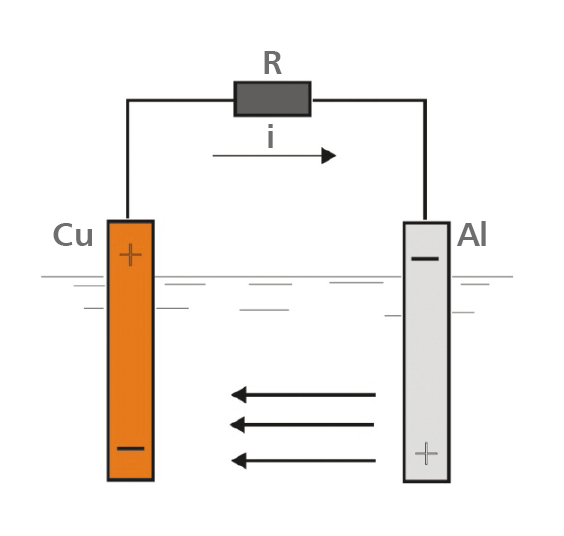
Przebieg procesu elektrochemicznego można wytłumaczyć na przykładzie elementu galwanicznego. Na rysunku 1 przedstawiono dwie sztabki (elektrody) zanurzone w wodzie słonej (elektrolicie), przy czym jedna wykonana jest z aluminium (lub stali), druga z miedzi, a zatem metalu bardziej szlachetnego. Po połączeniu ich nadwodnych części przewodem elektrycznym przez rezystor (opornik) R, następuje przepływ prądu spowodowany różnicą potencjałów między miedzią a aluminium. Na skutek tej różnicy potencjałów trwa w elektrolicie ciągły przepływ jonów od metalu mniej szlachetnego (kadłuba lub jego elementu) do metalu bardziej szlachetnego (śruby), co powoduje ubytki w materiale mniej szlachetnym (kadłubie lub w jego elemencie).
Jak zaznaczono na rysunku, prąd płynie pod wodą od sztabki aluminiowej będącej anodą (+) do sztabki miedzianej, czyli do katody (-). Nad wodą zaś od sztabki miedzianej, która tym razem spełnia rolę anody, do sztabki aluminiowej będącej nad wodą katodą. Prąd przepływa tylko wtedy, gdy obwód będzie zamknięty, a zatem w rzeczywistych warunkach, gdy gdzieś we wnętrzu jachtu nastąpi jego zamknięcie przez elementy przewodzące. Przykładowo ma to miejsce wówczas, gdy stalowy lub aluminiowy kadłub wyposażony jest np. w śrubę napędową wykonaną z bardziej szlachetnego materiału od stali lub aluminium, wał śrubowy wykonany np. z brązu bądź stopu Monela. Zjawisko korozji elektrochemicznej zachodzi nie tylko wtedy, gdy kadłuby wykonane są ze stali lub aluminium, ale także w przypadku, gdy pod wodą znajdują się elementy wykonane ze stali lub aluminium zamontowane w drewnianych lub laminatowych jachtach.
Zjawisko korozji może być bardzo groźne, prowadząc w skutkach do powstania nawet dziur w poszyciu jachtu i elementach napędowych. Zapobiega się temu, stosując tzw. bierną lub czynną ochronę elektrochemiczną. Ochrona bierna polega na umieszczeniu w strumieniu jonów (np. w pobliżu śruby) anody cynkowej (lub magnezowej przy ochronie elementów aluminiowych). Wówczas następuje przepływ jonów od cynku, czyli metalu mniej szlachetnego do miedzi, czyli metalu bardziej szlachetnego, w wyniku czego zostaje zniszczona po pewnym czasie anoda cynkowa (powstają w niej ubytki materiału), chroniąc kadłub stalowy lub stalowe elementy kadłuba wykonanego z innych materiałów niż stal. Na rysunku 2 widoczne są różne anody cynkowe do mocowania na kadłubie oraz na wale śrubowym.

Różne anody stosuje się także do zabezpieczenia okuć jachtowych, łańcuchów, ściągaczy, kotwic i innych. Do ochrony wału napędowego i podwodnych części silnika spalinowego stosuje się także (oprócz anod cynkowych) anody wykonane z magnezu lub ze stopów aluminium, ponieważ zużycie ich jest wolniejsze niż anod cynkowych. Niektóre silniki spalinowe chronione są także za pomocą anod umieszczanych na obudowach.
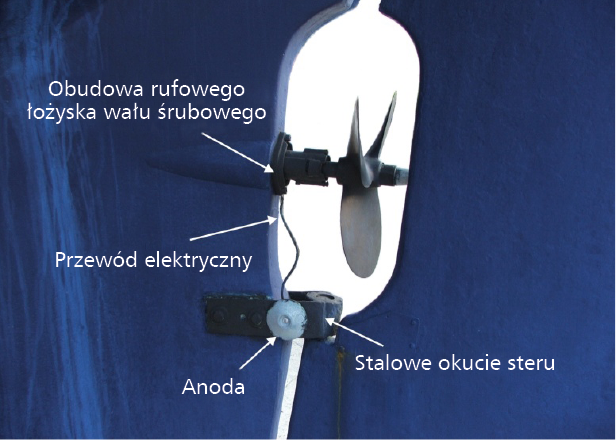
Na rysunku 3 widoczne są anody na stalowych elementach kadłuba jachtu wykonanego z drewna [3]. Na długim balaście zamocowanych jest po pięć podłużnych anod na każdej stronie balastu, na wspornikach wałów śrubowych znajdują się cztery anody i jedna anoda na każdym wale śrubowym.

Wszystkie okucia steru i inne posiadają, jak widać, także swoje anody. W celu polepszenia skuteczności ochrony przed korozją sąsiadujące ze sobą elementy okuć stalowych łączy się ze sobą, co pokazuje szczegół a, gdzie wspornik wału śrubowego połączony jest płaskownikiem z okuciem steru. Ogólnie anody muszą być tak zamontowane, aby miały jak najlepszy kontakt z ochranianą powierzchnią stali. Jeśli to jest trudne do spełnienia, wówczas anodę trzeba połączyć z ochranianym elementem za pomocą kawałka przewodu, co widać na szczególe b. Tu anoda przykręcona jest do drewnianej belki pochwy wału śrubowego i połączona kawałkiem przewodu z kołnierzowym zakończeniem pochwy. Podobne rozwiązanie widoczne jest na jachcie wykonanym z laminatu poliestrowo-szklanego (rys. 4), gdzie anoda przykręcona do stalowego okucia steru, chroniąca to okucie, połączona jest dodatkowo kawałkiem przewodu z obudową rufowego łożyska w celu jej ochrony przed korozją elektrochemiczną.
Inny przykład stosowanej ochrony przed korozją elektrochemiczną, tym razem zanurzonych części napędów, pokazano na rysunku 5.

Jak wyglądają anody z ubytkami materiału, widać wyraźnie na rysunku 6. Jedna z nich to anoda ochronna dziobowego steru strumieniowego, druga – umieszczona na kadłubie jachtu.

Zwykle gdy anody cynkowe zużyją się w około 50%, podlegają wymianie na nowe. W przybliżeniu przyjmuje się, że jedna anoda chroni powierzchnię do około 1,5 m2. Anod nie maluje się, żeby nie zmniejszyć powierzchni ich przewodzenia.
Trzeba jednak pamiętać, że taki rodzaj ochrony nie zabezpiecza całkowicie przed korozją elektrochemiczną, a raczej opóźnia ją, gdyż w niektórych warunkach może częściowo mieć miejsce przepływ jonów od metalu chronionego do bardziej szlachetnego.
Ochrona czynna polega na umieszczeniu między anodą (elementem aluminiowym lub stalowym) i katodą (elementem miedzianym) dodatkowej anody ochronnej połączonej z dodatnim biegunem źródła prądu (rys.7). Biegun ujemny źródła prądu połączony jest z płytką aluminiową (kadłubem). W wyniku takiego połączenia prądowego zanurzona część kadłuba, będąca do tej pory anodą, staje się katodą, a jony od anody ochronnej przepływają w stronę kadłuba.
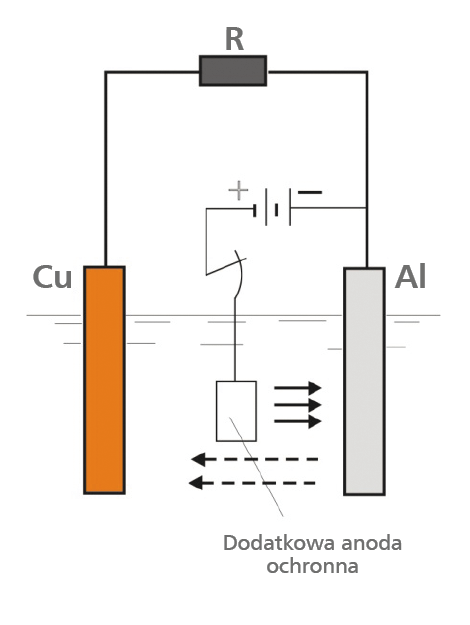
Mamy tu więc do czynienia z tzw. prądem polaryzującym. Przez pewien okres od chwili włączenia anody ochronnej trwa jednak jeszcze wędrówka jonów od kadłuba do śruby (płytki miedzianej). Ustaje ona po odpowiedniej, wielokrotnej regulacji napięcia źródła prądu i po pewnym upływie czasu, w wyniku czego następuje równowaga między jonami wędrującymi od anody ochronnej do kadłuba a jonami płynącymi w stronę miedzi. Dawniejsza anoda (kadłub) staje się więc całkowicie obojętna, czyli następuje polaryzacja. Całkowitą polaryzację osiąga się zwykle po upływie kilku do kilkunastu dni od chwili podłączenia anody ochronnej, a zależne jest to od stopnia zasolenia wody, wielkości kadłuba oraz warunków żeglugi.
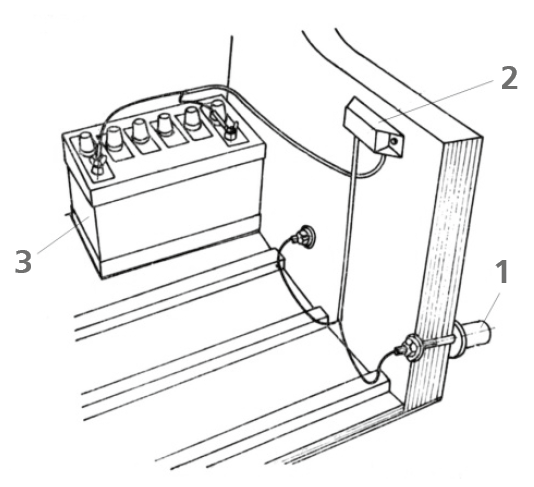
Anody ochronne wykonywane są z metalu o wysokim potencjale elektrochemicznym, np. z tytanu pokrytego platyną. W praktyce umieszcza się taką anodę ochronną na zewnątrz jachtu w części zanurzonej kadłuba, zaś doprowadzenie do niej prądu i do kadłuba następuje od strony wewnętrznej poszycia. Dokładne warunki instalowania urządzenia podawane są przez wytwórcę. W zależności od typu i wielkości jachtu stosuje się jedną lub więcej anod ochronnych. Na przykład jachty kilowe wymagają zastosowania dwóch anod, przy czym jedna umieszczona jest z jednej strony stępki, druga zaś z drugiej strony. Podobnie duże jachty motorowe powyżej 10 m długości wymagają stosowania także dwóch anod. Na jachtach spotykane są instalacje ochronne różnych wytwórni, spośród których bardzo rozpowszechniły się urządzenia angielskiej wytwórni Capac.
Na rysunku 8 pokazano w ogólnym widoku takie urządzenie przeznaczone do ochrony części napędowej na zewnątrz kadłuba, jak ma to miejsce w przypadku przekładni Z. Pracuje ono automatycznie, dostarczając do elektrod prąd potrzebny do kompensacji elektrolizy.
We wszystkich spotykanych urządzeniach ochronnych napięcie prądu jest bardzo małe, od 0,6 do 0,8 V.
Dr inż. Krzysztof Zbierski
Literatura:
[1] Milewski Z.: J Projektowanie i budowa jachtów żaglowych. Wydawnictwo Morskie, Gdańsk 1970.
[2] Pourbaix M.: Wykłady z korozji elektrochemicznej. Państwowe Wydawnictwo Naukowe, Warszawa 1978.
[3] Zbierski K.: Dieslowskie napędy jachtów. Wydawca Studio M, Łódź 2012.















